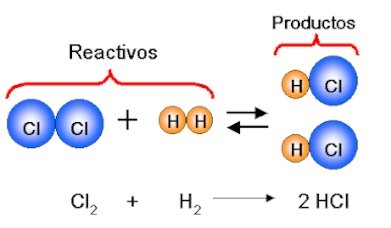
Cuando la reacción química se expresa como ecuación, además de escribir correctamente todas las especies participantes (nomenclatura), se debe ajustar el número de átomos de reactivos y productos, colocando un coeficiente a la izquierda de los reactivos o de los productos. El balanceo de ecuaciones busca igualar el de átomos en ambos lados de la ecuación, para mantener la Ley de Lavoisiere.
Existen dos tipos de balanceo de ecuaciones y son
Método por tanteos
Método por oxidación - reducción
MÉTODO POR TANTEOS
Este es utilizado para el balance de ecuaciones sencillas. La forma de realizar este balanceo es la siguiente
Seleccionar un compuesto que contenga el átomo de un elemento que se repita en la mayoría de las sustancias que intervienen.
Asignar a la formula del compuesto seleccionado un coeficiente tal que logre igualar el numero de átomos del elemento en reactantes y en productos. Dicho coeficiente debe ser el menor posible y afecta a todos los elementos, incluso a los índices.
repetir el procedimiento anterior con los átomos de los otros elementos hasta que la ecuación este balanceada.
Durante el balanceo se pueden ensayar varios coeficientes, pero los subíndices de las formulas no pueden ser alterados.
NÚMERO DE OXIDACIÓN
Los términos de valencia y numero de oxidación se consideran sinónimos a si que definiremos cada uno.
Número de oxidación: Es la carga eléctrica asignada a un átomo cuando se combina con otro.
Valencia: Es la capacidad de combinación de los átomos.
Para determinar el numero de oxidación de un átomo se realiza lo siguiente:
El numero de oxidación de cualquier elemento libre es cero.
Los metales alcalinos (grupo IA) tiene numero de oxidación +1.
Los metales alcalinotérreos (grupo IIA) tienen numero de oxidación +2.
El numero de oxidación de hidrógeno en la mayor parte de los compuestos es +1, pero en los hidruros metálicos iónicos, su numero es -1.
El oxigeno tiene numero de oxidación -2, excepto en los peróxidos que tienen numero de oxidación -1.
Todos los metales tienen numero de oxidación positivo.
La suma algebraica de los números de oxidación de todos los átomos en un compuesto debe ser cero.
La suma algebraica de los números de oxidación de los átomos de un cation debe ser igual a la carga del anion.